- トップ
- このサイトについて
- 理事会報告
- 役員
- 研究会
- 第62回放射線治療技術研究会
- 第61回放射線治療技術研究会
- 第60回放射線治療技術研究会
- 第56回放射線治療技術研究会
- 第55回放射線治療技術研究会
- 第54回岐阜県放射線治療技術研究会
- 第53回岐阜県放射線治療技術研究会
- 第52回岐阜県放射線治療技術研究会
- 第51回岐阜県放射線治療技術研究会
- 第15回岐阜県放射線技師学術大会
- 第49回岐阜県放射線治療技術研究会
- 第48回岐阜県放射線治療技術研究会
- 第47回岐阜県放射線治療技術研究会
- 第46回岐阜県放射線治療技術研究会
- 第45回岐阜県放射線治療技術研究会
- 第44回岐阜県放射線治療技術研究会
- 第43回岐阜県放射線治療技術研究会
- 第42回岐阜県放射線治療技術研究会
- 第41回岐阜県放射線治療技術研究会
- 第40回岐阜県放射線治療技術研究会
Last update 2017/04/28
昭和60年当時岐阜大学医学部放射線科の柳川繁雄先生が、岐阜地区4施設の放射線治療患者を診察していました。そこで、各施設の照射線量の計算方法が異なっていることを疑問に思い、「施設間の標準化を行っては」とのことから、昭和62年7月に岐阜県下の放射線治療に携わる医師、診療放射線技師が年3〜4回集まり情報や技術交流を図る目的で発足誕生しました。
平成5年1月から社団法人岐阜県放射線技師会主催の研究会として会則を整備し再出発をしました。
この研究会は、医師と診療放射線技師が協力して運営してきたため、医師の立場、技師の立場を超えて放射線治療について議論することができ、研究会には岐阜県はもとより、近隣の県から職種を問わず多数の職種が参加できる、開かれた会としています。
岐阜県の各地区より10名の世話人と2名の顧問が選出され、研究会担当理事とともに、研究会開催に当たっては、案内状の作成、送付、司会進行、報告書作成までを協賛メーカーの手を借りず、全て手作りで行っています。
ともすれば、技術偏重になりがちな研究会にあって、放射線治療という特殊な分野ということで、患者様の心のケアも含んだトータルな治療を目指して取り組んでいます。
第55回放射線治療技術研究会
| 教育講演 |
|---|
乳癌の放射線治療 岐阜大学医学部付属病院 放射線科 田中秀和 先生 |
||
国立がん研究センターがん対策情報センターによると2008年の女性の癌の罹患数の第1位は乳癌である。人口10万人あたり年間約90人が新たに乳癌と診断されており、岐阜県でも年間1900人弱が乳癌と診断される計算となる。またその罹患数は年々増加傾向である。一方、同統計による癌の死亡者数では乳癌は女性の第5位である。5年相対生存率は約89%と、適切な治療を行えば治癒を目指せる癌種である。 乳癌に対する放射線治療 乳癌治療には外科手術、化学療法(抗癌剤、分子標的薬、内分泌療法)、放射線治療を適切に組み合わせた集学的治療であたることとなる。本邦においては科学的根拠に基づく乳癌診療ガイドライン2013年版に則り治療方法を選択することが標準である。 乳房温存術後では原則全例に放射線治療の適応がある。全乳房に対し45-50Gyの照射が標準である。温存術後の全乳房照射ではリンパ節転移の有無にかかわらず局所再発を約1/3に低下することが報告されている[1]。70歳以上のER陽性患者に対し行われたTAM単独群とTAM + RT群のRCTでは遠隔転移や全生存に有意差なく、5年局所制御率のみ差がみられた(TAM単独群;4% vs. TAM + RT群1%)。その差は小さく、高齢で適切な内分泌療法が施行できる患者では全乳房照射を省くという選択肢も考慮はされる[2]。ガイドラインでは全乳房照射後に、原則全例で電子線によるブースト照射が推奨されている(推奨グレードB)。X線での全乳房照射後にブーストを行うことで局所再発率の低下が証明されているからである[3]。しかし本邦では切除断端陽性例もしくは近接例、若年者に限って施行されることが多い。これは欧米と我が国では切除断端陽性の定義が異なること(乳癌取扱い規約では、切除標本に5mm幅で割を入れ検索することが推奨されている)、40歳以下ではブースト照射の恩恵が特に大きいことなどが理由である。乳房温存療法の際、術後のQOL改善のため、腋窩郭清よりセンチネルリンパ節生検を施行することが推奨されている(推奨グレードA)。センチネル陽性であれば腋窩郭清を施行し、陰性であれば腋窩郭清を省略することが標準である。転移陽性リンパ節が最大径2mm以下である場合は微小転移(pN1mi)と表現され、その際は腋窩郭清の省略も許容される(推奨グレードC1)。またさらに微小で転移最大径が0.2mm以下の場合はIsolated Tumor Cells (ITCs)(pN0(i+))と表現され、転移陰性として扱う。 乳房切除後の放射線治療はPMRT(post mastectomy radiation therapy)と略され、腋窩リンパ節転移が4個以上陽性患者で推奨グレードA, 1〜3個陽性患者で推奨グレードBとして勧められている。リンパ節転移陽性例では胸壁および患側の鎖骨上窩をあわせて照射する。その他、腫瘍サイズが5cm以上の患者や切除断端が陽性・近接の患者も適応となるが、これらは胸壁照射のみが施行されることが一般的である。PMRTでも局所再発を約1/3に低下させることが報告されている[1] 放射線治療の開始時期に関しては術後20週を超えないように推奨されているが(推奨グレードB)、なるべく早期の開始が望ましい。ただし化学療法が必要な患者においては化学療法を先行させることが推奨され(推奨グレードB)、適切な化学療法が施行され放射線治療の開始が遅れた場合では局所再発は増加しないとする報告もある[4]。化学療法と放射線治療の同時併用は有害事象の増悪が懸念され推奨されない(推奨グレードC2)。一方、内分泌療法や分子標的薬との併用では有害事象の増悪は報告されておらず慎重に併用は可能とされる(推奨グレードC1)。ただし、乳癌診療でよく用いられるTrastuzumabは心血管系の有害事象が報告されており、照射との併用後の長期での有害事象の評価はまだなされておらず、同時併用には慎重であるべきである。 乳癌放射線治療後の副作用 治療に伴う有害事象はCTCAEで評価することが多い。放射線皮膚炎はほぼ必発である。放射線皮膚炎のほとんどはGrade1かGrade2である。放射線皮膚炎に対してはステロイド含有軟膏や抗生剤含有軟膏などを組み合わせて保存的に治療にあたる。 患側の照射された肺野には放射線肺臓炎が生じうる。放射線肺臓炎は画像所見のみで症状を伴わないGrade1がほとんどである。内科的治療を要するGrade2や酸素投与が必要なGrade3はそれぞれ2.3%, 0.5%と報告されている[5]。 BOOP/COPは照射野外に発生することが特徴である。自然寛解と増悪がみられ、時に陰影が移動したように見える。Crestaniらは照射後に起こるBOOP/COPを照射後12か月以内に起こり、2週間以上の全身症状・呼吸器症状を伴い、照射部と一致しない肺浸潤影を認め、他に原因のないものと定義している[6]。 その発生率は約0.77%〜2.5%と報告されている[7, 8]。またその多くは内分泌療法中の患者であるが、その原因は明らかでない。気管支鏡検査ではBAL中のリンパ球上昇が認められアレルギー的な機序が推測されている。また一度寛解しても再発が多いことも特徴である。自然寛解も望める疾患であるが、ステロイドを導入した患者ではステロイドを漸減し、中断した途端に再発することも経験され、ステロイド導入の適応に難渋することがある。 乳房温存術後に放射線治療を受けた患者のうち、左乳癌の患者は右側の患者に対して心・血管疾患の罹患が有意に多い[9]。また同様に心・血管イベントでの死亡も有意に多い[10]。左側乳癌患者の照射後に心エコーやシンチを行うと、39%に異常が見つかり、そのほとんど前下行枝(LAD)であったとする報告がある[11]。 放射線治療による副作用軽減のための工夫 Field-in-field(FIF)法を用いると、標的体積の線量均一性が高まると報告されている[12, 13]。高線量域の低減も可能であるため、放射線皮膚炎の軽減が期待される。またPhysical Wedgeを挿入する手間が省けるというメリットもある。 Deep inspiration breath-hold (DIBH)(深吸気息止め)での照射は肺や心への線量低下が報告されている[14, 15]。ただし、一回の照射に要する治療時間が長くなるデメリットもあり、スループットが低下する。乳癌の術後照射は決して少なくなく、日々の診療において始業から常にリニアックがフル稼働している施設では本手法を全例に適応することは困難と思われ、適切な症例選択が必要である。 最近のトピックス 本年7月より従来自費診療であった乳房再建が保険適応となった。今後、乳房再建を行う患者に対する照射の機会も増えていくと予想される。乳癌診療ガイドラインでは再建乳房に対する照射は筋皮弁による再建乳房、インプラントによる再建乳房ともに推奨グレードC1となっている。ただし照射後にエキスパンダーを留置するのは組織拘縮により困難となる。人工物で再建する場合はエキスパンダー留置後に照射を行うことになるが、インプラント挿入の前に照射するか、インプラント挿入後に照射するかにコンセンサスはない[16]。エキスパンダー留置後の拡張には時間を要するため、化学療法が必要な患者では拡張中に化学療法を施行することが望ましいと考える。 乳房温存術後の再発の7割は腫瘍床近傍から発生する。その他の部位からの再発は対側乳癌の発生様式と類似している。このことから、全乳房照射を行わず、部分的に照射を行い、かつ寡分割での照射を行う試みがある。Accelerated partial breast irradiation(APBI)と呼ばれ、ASTROのConsensus Statementでは60歳以上でER陽性、pT1N0M0, 単発で切除マージンが2mm以上確保されているものに適用とされている[17]。本邦では乳癌診療ガイドラインで推奨グレードC2とされており、臨床試験の枠組みでの施行が望ましいとされている。現在、ER陰性患者やリンパ節転移陽性患者も含めたRTOG0413試験が進行中であり、APBIの実臨床への適用は少なくともこの結果を待ってからとなる。 1.Clarke M et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials. Lancet, 2005; 366: 2087-2106 2.Hughes KS et al. Lumpectomy plus tamoxifen with or without irradiation in women 70 years of age or older with early breast cancer. N Engl J Med, 2004; 351: 971-7 3.Bartelink H et al. Impact of a higher radiation dose on local control and survival in breast-conserving therapy of early breast cancer: 10-year results of the randomized boost versus no boost EORTC 22881-10882 trial. J Clin Oncol 2007; 25: 3259-65 4.Recht A. Integration of systemic therapy and radiation therapy for patients with early-stage breast cancer treated with conservative surgery. Clin Breast Cnacer 2003; 4: 104-13 5.Kubo A et al. Risk factors for radiation pneumonitis caused by whole breast irradiation following breast-conserving surgery. J Med Invest, 2009; 56: 99-110 6.Crestani B et al. Bronchiolitis obliterans organizing pneumonia syndrome primed by radiation therapy to the breast. The Groupe d'Etudes et de Recherche sur les Maladies Orphelines Pulmonaires (GERM"O"P) Am J Respir Crti Care Med, 1998; 158: 1929-1935 7.負門ら.乳房温存療法による放射線治療後に発生する器質化肺炎の画像所見 臨床放射線, 2007; 52: 187-193 8.TakigawaN et al. Bronchiolitis obliterans organizing pneumonia syndrome in breast-conserving therapy for early breast cancer: radiation-induced lung toxicity. Int J Radiat Oncol Biol Phys, 2000; 48: 751-755 9.Borger JH et al. Cardiotoxic effects of tangential breast irradiation in early breast cancer patients: the role of irradiated heart volume. Int J Radiat Oncol Biol Phys, 2007; 69: 1131-1138 10.Bouillon K et al. Long-term cardiovascular mortality after radiotherapy for breast cancer. J Am Coll Cardiol, 2011; 57: 445-452 11.Correa CR et al. Association between tangential beam treatment parameters and cardiac abnormalities after definitive radiation treatment for left-sided breast cancer. Int J Radiat Oncol Biol Phys, 2008; 72: 508-516 12.Onal C et al. Dosimetric comparison of the field-in-field technique and tangential wedged beams for breast irradiation. Jpn J Radiol, 2012; 30: 218-26 13.Sasaoka M et al. Dosimetric evaluation of whole breast radiotherapy using field-in-field technique in early-stage breast cancer. Int J Clin Oncol, 2011; 16: 250-6 14.Borst GR et al. Clinical results of image-guided deep inspiration breath hold breast irradiation. Int J Raiat Oncol Biol Phys, 2010; 78: 1345-1351 15.Vikstr?m J et al. Cardiac and pulmonary dose reduction for tangentially irradiated breast cancer, utilizing deep inspiration breath-hold with audio-visual guidance, without compromising target coverage. Acta Oncol, 2011; 50: 42-50 16.Momoh AO et al. A Systematic Review of Complications of Implant-based Breast Reconstruction with Prereconstruction and Postreconstruction Radiotherapy. Ann Surg Oncol, Epub ahead of print DOI 10.1245/s10434-013-3284-z 17.Smith BD et al. Accelerated partial breast irradiation consensus statement from the American Society for Radiation Oncology (ASTRO).Int J Radiat Oncol Biol Phys, 2009; 74: 987-1001
|
||
|
頭頚部固定シェルがMUと皮膚線量に与える影響 中濃厚生病院 伊佐次範也 会員 |
||||
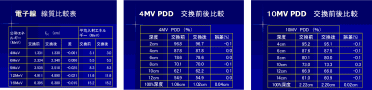
頚部領域(喉頭がんなど)の放射線治療において,高精度放射線治療を行うため治療期間中の患者固定の再現性を確保する目的で,頭頸部シェルが用いられる.しかし,シェルを用いることでX線のビルドアップにより皮膚線量が増加するとされているため,治療開始後にシェルを切り取ることが多い.しかし,治療計画前後で条件が異なるため,線量に影響を与える恐れが示唆される.そこで今回,シェルによりどれだけビルドアップの影響を受けるのか検証し,シェルの有無により治療計画装置上MUと皮膚線量に影響を与えるのか検証を行ったので報告する. 【使用機器】 ・放射線治療装置:Clinac-ix OBI System(Varian社製)6MV-X線を使用 ・放射線治療計画装置:Eclips(Varian社製) ・頭部用固定U字シェル:シェル厚2.4mm(村中医療器株式会社製) 元の横幅より+0cm〜+25cmとなるように作製. 【方法】 3次元水ファントムにて,Field size 5cm×5cmで深部量百分率(PDD)を計測.作製したシェルを線量計の上にセットし,同様にPDDを計測. 蛍光ガラス線量計と平行平板型電離箱線量計にて水等価ファントム上にセットしシェル有無の表面線量を計測し,線量上昇の割合を算出した.各点5回計測の平均にて比較. シェルの有無で治療計画用CTを撮像し,放射線治療計画装置にてMUとDVH(Dose Volume Histgram)の比較を行った. 【結果】 PDD・蛍光ガラス線量計・平行平板型電離箱線量計全てにおいてシェルを使用することで表面線量は上昇した.シェルの有無でMUについては同じ値となった.また,皮膚線量についてもDVHは一致した. 【考察】 シェル使用時はX線ビルドアップの影響を受け,表面付近の線量上昇を確認することができた.治療計画装置にてシェルの有無でMUと皮膚線量(DVH)に相違がみられなかったことから,シェルのCT値が治療計画に影響を与えないことが実証できた.今回の実験結果より治療開始後にシェルを切り取っても治療計画に影響ないと考える.また,治療計画でシェルを含めなくても影響ないことが分かった. |
||||
|
| 特別講演 |
|---|
リニアックの物理と構造 エレクタ株式会社 営業マーケティング本部 岩井良夫 先生 |
|
電子銃は2極管タイプと3極管タイプがあるが、この形式の違いは組み合わされる加速管のタイプに依存する[1]。進行波型加速管の場合は、加速管への高周波(RF)と電子線を同時に注入して加速する。電子銃の引き出し電圧としてRF生成に用いる高電圧のパルスをそのまま利用できるため、2極管タイプが用いられる。定在波型加速管の場合は、加速管へ高周波(RF)が注入されてから、加速に利用できる定在波が形成されるまでに約1 μsのFiling timeと呼ばれる時間差があり、加速管に電子を注入するタイミングをRFの注入のタイミングと別に制御する必要があるため、3極管タイプの電子銃が必要となる。 RF発生装置・増幅装置としてマグネトロンとクライストロンが利用されている。マグネトロンはRF発生装置で動作電圧が約50 kVで水冷駆動のため、ガントリーに搭載される。クライストロンはRF増幅装置で、最大出力はマグネトロンを上回るが、その動作電圧は約120 kVと高いため油冷と遮蔽が必要となり、ガントリーとは別に設置される。そのため、クライストロンの場合はRF を発生させるgeneratorとロータリージョイントと組み合わせて利用される。 加速管は進行波型加速管と定在波型加速管がある。どちらの加速管も電子の加速を妨害する分子を排除し、空洞内部の放電を防ぐために真空にしている。進行波型加速管は円筒形の加速空洞が並ぶシンプルな構造で、定在波型に比べて電界強度が低いために加速管は長くなるが、必要とされる真空度は低い。定在波型加速管は進行波と反射波の合成で生成される定在波を用いるため電界強度が高く、必要とされる真空度は高いが、加速管は短縮される。加えて、電子の加速に寄与しない空洞を加速管の軸から外して配置するside coupling cavityによって、複雑な構造となるが加速管は短い。 汎用型医用リニアックの加速器部分について概説しました。研究会の皆様の一助になれば幸いです。 参考文献 [1] D. Greene, P. C. Williams, Linear Accelerators for Radiation Therapy, Taylor & Francis, 1997. |
|
| |